Causas de la oxidación y corrosión

Generalidades
La exposición constante de los materiales a la acción de los ambientes con los que están en contacto provoca una interacción que puede ocasionar el deterioro de las propiedades físicas de los materiales. Según sean éstos, variará el mecanismo de deterioro.
En el caso de los metales, el proceso de deterioro recibe los nombres de corrosión y oxidación. Los procesos de deterioro de los materiales cerámicos suelen darse a temperaturas elevadas o en ambientes extremadamente adversos, hablándose también de corrosión. Por el contrario, se utiliza el término «degradación» en el caso de los polímeros.
Corrosión y oxidación
La corrosión, puede definirse como una destrucción lenta y progresiva de un metal, por la acción de un agente exterior y por causas distintas a la producida por la acción mecánica; por ello, el desgaste o la erosión de los metales no se concibe como “corrosión”.
Cabe destacar que, existen procesos tales como corrosión-erosión o corrosión bajo tensiones, en los que, se dan de modo combinado acciones electroquímicas y mecánicas.
En cualquier caso, el metal pasa del estado elemental a formar iones positivos (cationes) por pérdida de electrones, en lo que llamamos reacción de oxidación.
Técnicamente es interesante distinguir entre dos procesos de deterioro de metales: oxidación directa y corrosión electroquímica.
La oxidación directa hace referencia a la combinación de los átomos metálicos con los de la sustancia agresiva.
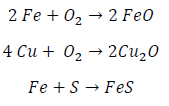
La oxidación directa tiene gran importancia en las aplicaciones de los metales a altas temperaturas, cuando no existe humedad sobre la superficie del metal.
La corrosión electroquímica, en cambio, se origina por la presencia de pilas electroquímicas en las que el metal actúa como ánodo y, en consecuencia, disolviéndose.
La corrosión electroquímica exige que se establezca contacto con ambientes acuosos y, en general, con medios de conductividad electrolítica.
Mientras que, en el caso de oxidación directa, toda la superficie metálica es afectada prácticamente por igual. Por el contrario, en las piezas que sufren corrosión electroquímica, solamente se verán afectadas las áreas anódicas, pero no las catódicas.
Es un hecho conocido que, algunos materiales metálicos se deterioran rápidamente, mientras que otros son relativamente estables. Por otra parte, se observa que, la velocidad de oxidación se va reduciendo con el tiempo en algunos casos y en otros se mantiene constante e incluso aumenta.
Estos comportamientos guardan relación, con ciertas características propias de las películas de óxido formadas sobre los metales y las aleaciones.
Así pues, podemos decir que, las películas de óxido se dividen entre protectoras y no protectoras, en función de si frenan o no, el proceso de oxidación y, en consecuencia, el crecimiento de la película de óxido formada.
En este sentido, la regla de Bedworth-PiIling (aunque tiene bastantes excepciones), permite formarse una idea del posible comportamiento de un determinado metal, a altas temperaturas y en una atmósfera oxidante.
Según Bedworth y Pilling, si la relación que existe entre el volumen de óxido y el volumen de metal consumido en su obtención (llamado “R”) es menor que 1, los óxidos que se formen no serán protectores, debido a su porosidad. Por el contrario, si esa relación resulta mayor que 1, el óxido será compacto y, en este caso, protector.
También nos indica que, si la relación entre ambos es muy superior a la unidad, los óxidos pueden perder el carácter protector debido a que, se podrían formar fisuras, debido a su gran volumen, por lo que se podría producir su resquebrajamiento.
Unos ejemplos de películas protectoras son las de los óxidos de aluminio y los del cromo, cuyos valores de R son 1,28 y 2,07, respectivamente.
Son películas no protectoras con valores de R menores a la unidad, las de los óxidos de calcio y sodio, con valores de R, 0,64 y 0,57, respectivamente. Son también películas no protectoras, en este caso por valores de R excesivamente elevados, las de óxidos de molibdeno y de wolframio, cuyas relaciones son 3,40 y 3,35 respectivamente.
Tipos de corrosión.
Podemos diferencias los siguientes tipos de corrosión: corrosión uniforme, localizada, intergranular, selectiva, bajo tensiones, corrosión-erosión y corrosión con fatiga.
Corrosión uniforme
En este caso, el metal adelgaza uniformemente, como, por ejemplo, cuando se ataca una plancha de cobre con ácido nítrico.

La resistencia mecánica decrece proporcionalmente a la disminución del espesor. Las unidades en que se expresa la pérdida de material son miligramos por decímetro cuadrado y día.
Conociendo la densidad del metal que se corroe, es fácil calcular a partir de la pérdida en peso, la disminución del espesor.
Corrosión localizada

Cuando se produce una corrosión localizada, el metal resulta “picado”, terminando en general por quedar con una rugosidad en su superficie. En este caso, la capacidad de deformación del metal disminuye más rápidamente de lo que podría esperarse por la pérdida de masa. Un caso típico de este tipo de corrosión, es la provocada por el agua de mar sobre el hierro.
Corrosión intergranular
La corrosión intergranular es un tipo de corrosión que afecta a la unión de los granos constituyentes de los metales, debilitando sustancialmente la resistencia del conjunto, hasta el punto de romper, sin que exteriormente presenten síntomas de la debilidad que adolecen ni se vea afectada la superficie del metal.
Oxidación selectiva
Un ejemplo clásico es la pérdida de cinc (descincadao) de los latones, que son aleaciones de cobre-cinc. La pérdida de cinc, deja una masa porosa de cobre, de muy baja resistencia.
Corrosión bajo tensiones
Este tipo de corrosión suele darse cuando actúan esfuerzos estáticos superficiales de tensión, combinados con un medio corrosivo.
Los esfuerzos pueden ser también residuales, como consecuencia del proceso de fabricación o del uso del metal.
Corrosión-erosión
La erosión se debe al flujo turbulento de fluidos que contienen sólidos en suspensión. La combinación de este efecto mecánico con un medio corrosivo, acelera el deterioro del metal.

Corrosión con fatiga
Es otro caso de efecto combinado mecánico-corrosivo y se debe a la acción de un medio agresivo sobre el metal, sometido a la vez a esfuerzos variables.
*Potencial en solución salina de actividad iónica normal con relación al electrodo normal de hidrógeno como punto cero arbitrario.
La pila de corrosión
Entendemos como “pila” por estar constituida por ánodo y cátodo. En el ánodo tiene lugar la oxidación, o sea, la pérdida de electrones, mientras que, en el cátodo se produce la reducción, que es la reacción en la que hay ganancia de electrones.
Como ejemplo, si se sumerge una varilla de hierro en una disolución de ácido clorhídrico HCl, la reacción de oxidación es:
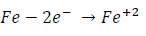
y la reacción de reducción es:
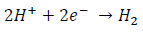
pero si en lugar de introducir la varilla de hierro en ácido se deja a la intemperie, de modo que haya humedad (agua) y aire (oxígeno), la reacción anódica de oxidación sigue siendo:
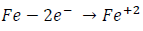
Mientras que la reacción catódica o de reducción puede ser:
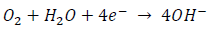
En la que hay ganancia de electrones. La reacción total es:
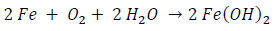
el hidróxido ferroso, en una etapa posterior se oxidará a Fe(OH)3 (herrumbre) según la reacción:
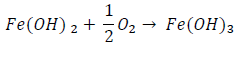
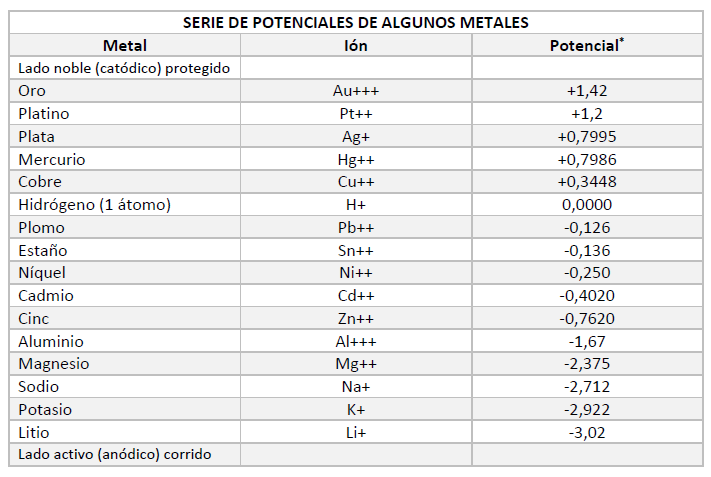
Se puede conocer el comportamiento anódico o catódico de un determinado metal, consultando la Serie Electroquímica de Tensiones, anteriormente expuesta.
Esta serie se estableció, asignando el valor cero al potencial del electrodo normal de hidrógeno, que consiste en una placa de platino, cubierta con negro de platino y sumergida en ácido clorhídrico de actividad 1 M en la atmósfera de hidrógeno purísimo a la presión de 1 atmósfera.
En la serie electroquímica de los metales hay elementos que son positivos con respecto al hidrógeno y se colocan en el «lado noble» de la escala. En el extremo contrario, que se denomina «lado activo», están situados los elementos de potencial negativo con respecto al hidrógeno.
Así, el potencial de un electrodo constituido por una varilla metálica sumergida en una disolución C molar de sus iones (en disoluciones diluidas se puede sustituir la actividad por la concentración) se calcula aplicando la ecuación de Nernst:
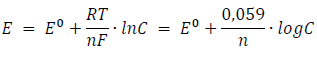
en donde Eº es el potencial normal del metal en cuestión y n es el número de electrones que se transfieren cuando un átomo de metal pasa a formar ión positivo en una reacción de oxidación, o a la inversa, si la reacción es de reducción.
Así, el potencial del electrodo de Fe sumergido en una disolución de iones Fe+2 de concentración 0,1 M es:
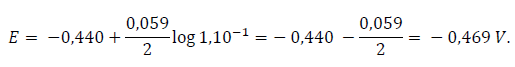
mientras que el electrodo de cobre en presencia de iones cúpricos de concentración 0,1 M será:
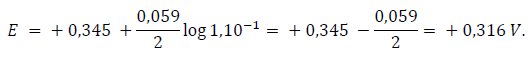
En consecuencia, si se unen los dos electrodos el proceso tendrá lugar según las reacciones:
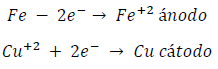
siendo la reacción total:
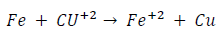
Por otra parte, se origina una pila de concentración cuando se introducen dos electrones del mismo metal, por ejemplo, cinc, en dos disoluciones de diferente concentración de sus iones.
En efecto, si suponemos que en un recipiente hay una concentración de iones Zn++ = 0,1 M y en otro Zn++ = 0,01 M, al aplicar ambas semipilas la ley de Nernst, encontraríamos que, para el primer caso, el potencial del electrodo de cinc sería:
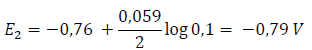
mientras que para el segundo:
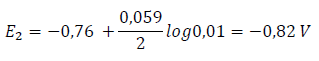
Así pues, podemos comprobar que el más diluido (2) de los semielementos actuará como ánodo (negativo) y el más concentrado como cátodo (positivo). De esto se deduce que, en los casos de pilas de concentración, la región de menor concentración será la que experimente corrosión.
Un caso particular de pilas de concentración es el de las pilas de aireación diferencial, que se originan cuando zonas del mismo metal están en contacto con abundante oxígeno (cátodo) y otras partes menos accesibles para el oxígeno actúan como ánodos. Un ejemplo típico de ello, son las tuberías y sus uniones roscadas.
Ejemplos de corrosión galvánica
En general, cuando dos metales estén en contacto en una solución, el metal de menor potencial de la serie galvánica (o sea, el que esté más cerca del «lado activo» y actúe, por tamo, de ánodo), es el que sufrirá la corrosión.
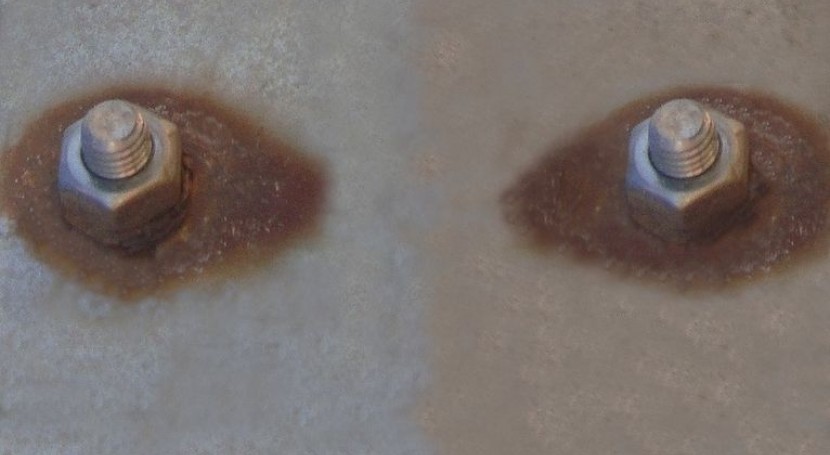
Así, por ejemplo, si en una plancha de hierro galvanizada (recubierta de cinc) se produce un poro en el revestimiento de cinc, éste, que es el de menor potencial, actuará de ánodo, y el hierro, de cátodo, produciéndose la corrosión en el ánodo, es decir, en el cinc.
En cambio, si en una placa de hierro estañado se produce un poro en la película de estaño, como el hierro es de menor potencial, actuará de ánodo, resultando afectado de corrosión.
La posición de los metales en la serie galvánica no da una indicación absoluta de la forma en que se ha de producir la corrosión, pues a veces diversos factores hacen cambiar la polaridad. Por ejemplo, los jugos ácidos de algunas frutas en conserva hacen al estaño anódico y al hierro catódico, no produciéndose corrosión en el interior de los botes de conserva.
Para que se produzca la corrosión no es necesario que los metales estén en contacto, sino que, suficiente que estén próximos. De hecho, tampoco hace falta una solución salina, pues la corrosión se produce en un metal enterrado si en las proximidades hay otro catódico con respecto a él. Puede producirse la corrosión sin que ni siquiera exista otro metal, bien sea por heterogeneidad en el metal o por heterogeneidad en el medio circundante.
Corrosión por heterogeneidad del metal
Este tipo de corrosión la podemos ver en un caso típico, cuando un trozo de tubería nueva insertada en un tramo de tubería vieja, puede corroerse rápidamente, pues, en general, actuará de ánodo (la tubería nueva) y de cátodo la vieja.
Una impureza cercana a la superficie de un metal es suficiente para iniciar una corrosión electroquímica; la impureza hará de cátodo, y el hierro, de ánodo.
Otra causa típica de corrosión es la provocada por un poro en la cascarilla de laminación. Entre esta cascarilla, que resulta catódica con respecto al hierro, y éste, se produce una pila de corrosión.
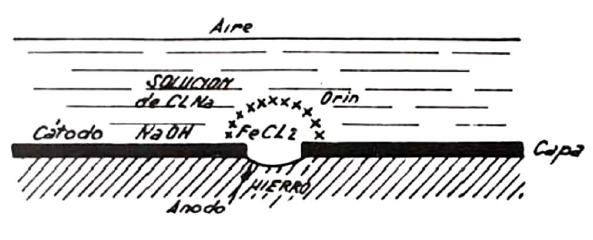
Pueden ser también causa de corrosión las tensiones internas o externas a las que quede sometido un metal, el estado de acritud después de un trabajo en frío, el rayado de su superficie y, en general, los diversos tratamientos químicos o térmicos, que acentúan las causas de heterogeneidad y, por consiguiente, las causas de corrosión.
Corrosión por heterogeneidad del medio circundante
Las diferencias de temperatura, de concentración y, sobre todo, de contenido de oxígeno, son causas muy frecuentes de corrosión.
En este tipo de corrosión, que se denomina efecto Evans, las partes de una pieza menos aireadas, como, por ejemplo, los ángulos vivos, rayas profundas. etc., funcionan como ánodos y son inmediatamente atacados. Esta misma clase de corrosión es la que se produce en una pieza medio sumergida, en la que la porción próxima a la superficie del agua y, por tanto, más oxigenada es catódica, y la parte inferior, menos oxigenada, es el ánodo, que es el que se corroe.
Aún existe otro ejemplo clásico de esta corrosión producida por aireación diferencial. Es el de la corrosión producida por una gota de solución salina sobre una plancha de hierro o de cinc que resulta atacada en el centro de la gota, donde se produce cloruro ferroso, mientras que, la periferia, a la que tiene fácil acceso el oxígeno, actúa de cátodo, formándose entre las dos zonas una línea muy marcada.
Una circunstancia muy importante que hay que tener en cuenta en la corrosión galvánica, es la referida a la relación entre las áreas catódicas y anódicas. Si el área catódica es grande, con relación a la anódica, ésta sufrirá una corrosión muy intensa, y al revés, si el ánodo es grande con relación al cátodo, la corrosión será débil.
Corrosión electroquímica (con fuerza electromotriz exterior aplicada)
En los casos de corrosión electroquímica hasta ahora considerados, ha sido el propio metal, dos metales en contacto o muy próximos los que han proporcionado la fuerza electromotriz para la corrosión electroquímica. Por esto, la velocidad de ataque, y por tanto la corrosión, está forzosamente limitada. Pero cuando se aplica una fuerza electromotriz exterior, las velocidades pueden ser mucho mayores.
Un caso típico de corrosión electroquímica es el producido por las corrientes de retorno de los tranvías, que, como se sabe, tienen vuelta por tierra. Aunque teóricamente el retorno de la corriente debía hacerse por los carriles, en la práctica penetra y se distribuye en una zona alrededor del carril, y si encuentra algún tubo metálico o cubierta metálica de cables que tiene dirección apropiada, parte de la corriente pasa por él para volver más adelante a los mismos carriles o, a veces, a carriles diferentes de otras líneas que tengan el retorno común. La fracción de corriente eléctrica que sigue el camino indicado es pequeña, si las calles están bien pavimentadas y el terreno es seco; pero si el terreno es húmedo, estas corrientes vagabundas alcanzas cierta intensidad y producen serios perjuicios. Se calcula que 1 amperio circulando durante 1 año, puede destruir 9 kg de hierro o 34 kg de plomo; pero como el ataque no es uniforme, sino que se produce siguiendo los bordes de los granos, cualquier tubo o funda puede resultar perforado, aunque el peso del metal destruido sea pequeño.
En realidad, se forman dos pilas electrolíticas en serie, constituida por:
Raíles de acero (ánodo) – Terreno húmedo – Tubos de acero o cubiertas de plomo (cátodo)
Tubos o cubiertas (ánodo) – Terreno húmedo – Raíles (cátodo)
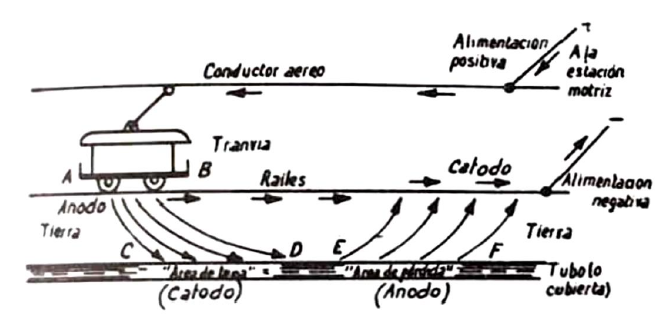
La corrosión se produce en los raíles entre A y B, y en los tubos o cubiertas entre E y F. La corrosión de los carriles, de hecho, no tiene mucha importancia, porque se necesita antes su reposición por desgaste que, por el efecto de la corrosión, pero los daños en los tubos sí pueden llegar a ser muy graves.
Un tipo de corrosión parecido a éste es el que ha tenido lugar alguna vez en los edificios de estructura metálica, que tenían circuitos eléctricos en contacto con la estructura.
La protección para evitar la corrosión por corrientes vagabundas puede realizarse por varios sistemas, que a veces se aplican simultáneamente para mayor garantía de la protección.
Puede utilizarse un drenaje eléctrico, uniendo todas las cubiertas metálicas de cables o tubos, a través de resistencias, a la alimentación negativa, para que todo el tubo sea catódico con respecto al terreno, y así no existan posiciones anódicas. Este sistema hay que usarlo con discreción, pues si la corriente que circula por las tuberías es muy intensa, puede producir la corrosión anódica en otros tubos no incorporados al drenaje.
También ha dado buen resultado interrumpir con juntas aislantes las cubiertas de cables o los tubos, con lo que se reduce la corriente que pasa por ellos. Estos aislamientos deben ser muy eficaces, pues si no lo son y sigue circulando corriente, en cada unión se establecerá una pila electrolítica y se producirá corrosión en el lado anódico de la junta. En los tubos de agua, el ataque se producirá por el interior, puesto que la corriente seguirá pasando por el agua,
También pueden emplearse barras de sacrificio, haciendo buen contacto con los tubos, para que la corriente salga por las barras, resultando éstas corroídas.
Las pinturas a base de alquitrán, betún o cualquier otro recubrimiento no metálico, también pueden emplearse, tal como veremos más adelante. Cabe destacar que, estos tipos de recubrimientos deben ser debidamente aplicados, pues, si se dejan algunas zonas sin recubrir, el ataque será mucho más intenso aún en ellas, que las que sufriría el material estando desnudo.
Corrosión química
Acción de loa ácidos no oxidantes.
Si un metal entra en contacto con un ácido no oxidante (como por ejemplo: ácido sulfúrico, clorhídrico, etc.), en un recipiente cerrado, generalmente serán reemplazados en el ácido los iones de hidrógeno por los Iones metálicos hasta restablecer el equilibrio, en la siguiente reacción:
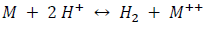
Esto ocurrirá cuando el potencial M|M++ iguale al potencial H2|2H+, en la superficie metálica. Para que esto ocurra, debe aumentar la concentración de hidrógeno en el líquido, con el consiguiente aumento de presión, en el espacio gaseoso por encima de él.
Si el metal está en el lado «activo» de la serie galvánica, el equilibrio sólo se alcanzará cuando la presión se haya hecho muy grande. Si el ataque tiene lugar, no en recipiente cerrado, sino al aire libre, el equilibrio será imposible y la reacción continuará hasta agotarse el metal, con desprendimiento de burbujas en los metales más activos y por difusión lenta a través del líquido, en los metales menos activos. Las reacciones de corrosión son:
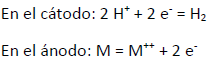
Estas reacciones pueden verificarse en puntos contiguos y alternativamente en un mismo punto.
Si el metal está en lado «noble», como el plomo, la plata, el cobre, etc., basta una pequeña concentración de hidrógeno para que cese la reacción, siendo suficiente una presión inferior a la atmosférica para que deje de desprenderse hidrógeno y se interrumpa, por tanto, el ataque del metal con el ácido.
El hierro resulta atacado por los ácidos no oxidantes, favoreciendo este ataque la presencia de azufre en forma de sulfuro de hierro o manganeso, debido a un erecto catalizador.
Acción de los ácidos oxidantes
Los metales del lado «activo» se disuelven, en general, en forma de nitratos en el ácido nítrico, produciendo, en lugar de hidrógeno libre, compuestos hidrogenados como el amoniaco (NH3) y la hidroxilamina (NH20H).
Los metales del lado «noble» son atacados por el ácido nítrico (NO3H), y más violentamente si no se agita el líquido, pues los productos de la reacción obran como catalizadores.
El ácido nítrico, además de ácido, es un agente oxidante y puede producir películas protectoras de óxido férrico (Fe203) en la superficie del hierro, cesando entonces el ataque porque la película lo protege, aunque se disuelve, pero muy lentamente. Así se establece una lucha entre las propiedades ácidas y oxidantes del reactivo.
Si el ácido está diluido, prevalece el ataque del ácido y la corrosión tiene lugar violentamente. Pero si el ácido está concentrado, prevalece la acción oxidante, y tras un ligero ataque al principio, queda el hierro autoprotegido. Puede pasivarse el hierro introduciéndolo en ácido nítrico concentrado, lo que le permite resistir la acción del ácido diluido, que atacaría al hierro normalmente.
Acción de los álcali
EI cinc, aluminio, plomo, estaño y el cobre son atacados por una solución de hidróxido sódico. Los metales más resistentes a los álcalis son el níquel, la plata y el magnesio.
Velocidad de corrosión
La velocidad de corrosión, así como la densidad de corriente de corrosión, se pueden calcular mediante la ley de Faraday.
Como es sabido, esta ley se expresa de modo resumido de la siguiente manera: la cantidad de electricidad de 96.500 culombs (Faraday) depositan en el cátodo o disuelven en el ánodo un equivalente-gramo del elemento estudiado.
Esto se puede expresar:
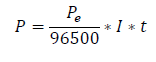
Peso del metal disuelto: P
Peso equivalente del metal: Pe, que se calcula dividiendo su masa atómica (Ma) por su valencia (v). Intensidad de la corriente, expresada en amperios: I
Tiempo expresado en segundos, que dura el paso de la comente: t.
En corrosión interesa, generalmente, la pérdida en peso de un área S determinada, por unidad de tiempo. Si dividimos los dos miembros de la ecuación anterior por S y obtenemos la velocidad de corrosión (gr/cm2·s), que es igual a una corriente constante multiplicada por la densidad de corriente, expresada en A/cm2:
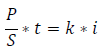
Polarización
Se denomina polarización, a la modificación del potencial del ánodo y/o cátodo que, a su vez, afecta a la corriente de la pila.
Si se consigue aumentar el grado de polarización de las pilas, que son causa de la corrosión de los metales, se logra reducir la velocidad de las reacciones de pila y, en consecuencia, la velocidad de corrosión.
Se conocen tres tipos de polarización: por activación, por concentración y por resistencia.
La polarización por activación está relacionada con la energía necesaria para que trascurran las reacciones en el ánodo y/o en el cátodo. Es el resultado inmediato de la barrera de energía en la intercara electrodo/electrolito.
La polarización por concentración representa la variación en el potencial de un electrodo a consecuencia de los cambios de concentración en la vecindad de superficie originados por el flujo de corriente, que modifica la composición del electrólito. Disminuye con la agitación o con cualquier medida que ayude a homogeneizar el electrólito
La polarización por resistencia u óhmica puede ser originada por la formación de películas o precipitados sobre la superficie metálica, que se opongan al paso de corriente, en casos extremos, de formación de capas de óxido aislantes, puede ser muy elevada.

