Introducción
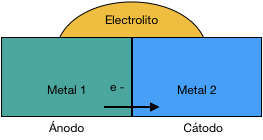
El diseño de cualquier proyecto metalúrgico, puede hacer necesaria la combinación de diferentes materiales metálicos, en un mismo componente. De la misma manera, es sumamente probable que entren en contacto dos materiales diferentes, debido a los herrajes y elementos de fijación utilizados, ya sean tornillos, remaches, grapas, etc. En determinadas circunstancias, los diseños con materiales disimilares pueden dar lugar a la corrosión en uno de los mismos. Este fenómeno podría estar ocasionado por la llamada corrosión galvánica, en la que dos metales distintos, forman un par galvánico.
Como consecuencia de ello, se puede producir una corrosión acelerada del material que sea “menos noble”. Éste, podría registrar un nivel de corrosión mucho mayor el que se esperaría sin ningún tipo de contacto con el metal del par más noble. Los daños producidos por este tipo de corrosión, suelen desencadenar en el deterioro del material, hasta estados de total deterioro que los hacen irrecuperables.
El riesgo existente para que se dé este tipo de proceso de corrosión, depende de una gran cantidad de factores. Además de los materiales usados, como es obvio, son influyentes y determinantes, factores como el entorno y el diseño de las piezas. Por lo tanto, resulta inviable hacer una valoración a priori acerca de la compatibilidad entre los materiales, sin un estudio ad-hoc.
Principios elementales
Como concepto general, podemos afirmar que, para que se inicie un proceso de corrosión galvánica, debe darse que:
- Los dos metales deben tener diferente potencial de corrosión.
- Exista contacto físico entre los dos metales.
- Exista una capa eléctricamente conductora entre ambos, que actúe como electrolito.
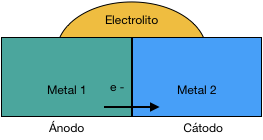
Cuando se da la situación antes descrita, el metal que sea menos noble, actuará como ánodo y se verá atacado por el que más lo sea, que actuará como cátodo. Éste, por el contrario, se ve incluso protegido contra la corrosión. De hecho, el principio de la protección catódica se basa en ánodos de sacrificio que proporcionan protección contra la corrosión.
El contacto entre dos metales con distinto potencial, en una solución eléctricamente conductora, da lugar a un flujo de electrones de ánodo hacia cátodo. De hecho, las reacciones electroquímicas son las mismas que podrían producirse de forma natural en el metal aislado; sin embargo, en el caso de la transferencia de electrones, como consecuencia del par galvánico, el ataque corrosivo en el ánodo se acelera enormemente y degrada mucho el material. En muchos casos, la formación del par galvánico, puede dar lugar a la corrosión en materiales que, de otra forma, podrían ser resistentes a la corrosión, en el entorno donde se encuentra. Este puede ser el caso para los materiales, que podemos catalogar de “pasivos”, como lo es el aluminio, el cual puede llegar a polarizarse en determinadas circunstancias. En esos casos, se pueden observar fenómenos de corrosión localizada tales como corrosión por picaduras o la corrosión por intersticios, lo que no se habría dado sin el cambio en el potencial causado por la formación de un par galvánico.
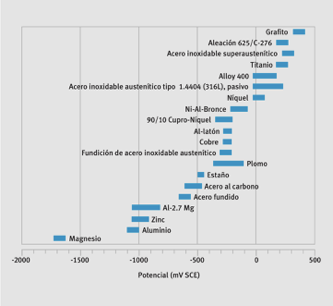
Cabe destacar que, en realidad, el factor decisivo no es la diferencia de potencial observada en condiciones experimentales estandarizadas, como se indica en algunas tablas publicadas sobre el efecto de la corrosión por par galvánico, sino que más bien lo es, la diferencia de potencial en condiciones de funcionamiento reales. Esta es la razón por la que se han creado tablas empíricas de series galvánicas para entornos típicos, tales como el agua del mar. Éstas colocan el potencial de diversos metales en un entorno determinado, como se indica en la siguiente figura.
A continuación, se muestran esquemáticamente, las situaciones en las que no se da el proceso de corrosión por par galvánico, cuando:
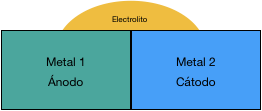
- No existe contacto entre los metales
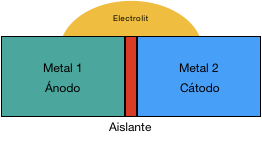
2. No hay diferencia de potenciales, entre los dos metales
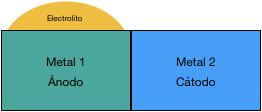
3. No hay conexión a través de un electrolito
4. No hay contacto entre el electrolito y los metales o, al menos, con uno de ellos
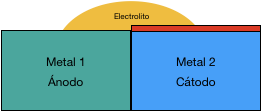
Respecto a éste último caso, cabe apuntar que, debido a las características eléctricas del proceso de transferencia entre los metales de diferente potencial, en el caso de querer aislar sólo uno de los metales del electrolito, deberemos aplicar el aislamiento sobre el metal que vaya a actuar de cátodo.
Factores relevantes
De acuerdo con la ley de Faraday, los procesos de corrosión electroquímica están directamente relacionados con la transferencia de carga, es decir, al flujo de corriente. La corriente o la densidad de corriente se usa, por lo tanto, muy a menudo para medir la corrosión.
1. Resistencia del electrolito
El riesgo de corrosión galvánica disminuye al aumentar la resistencia del electrolito. Esto se debe a que se reduce el alcance de la corriente galvánica y se limita el cambio de potencial en el ánodo.
2. Tiempo de exposición al entorno.
Existe una fuerte interacción entre la resistencia del electrolito el tiempo de exposición a l entorno, o mejor dicho, a la humedad que contiene. Esto es de vital importancia en lugares donde los componentes no estén permanentemente mojados por líquidos acuosos. Como ya hemos visto, el electrolito juega un papel clave, puesto que sin dicho electrolito no se podría dar ningún proceso de corrosión galvánica.
| Entorno | Conductividad especifica (Ω•cm)-1 |
| Agua pura | 5•10-8 |
| Agua desmineralizada | 2•10-6 |
| Agua de lluvia | 5•10-5 |
| Agua potable | 2•10-4 a 1•10-3 |
| Agua de río | 5•10-3 |
| Agua de mar | 3,5•10-2 a 5•10-2 |
Corolario
Una vez repasados los principios básicos por los cuales se produce el proceso de corrosión, por culpa del par galvánico, podemos concluir diciendo que:
- Debemos prestar mucha atención en la elaboración de un proyecto metalúrgico, cuando en él participan diferentes metales como el aluminio, acero, zinc, entre otros, y estarán en contacto, por ser metales con diferentes potenciales.
- Si los materiales que participan pudieran interferir entre sí, se habrían de adoptar medidas de protección.
- Puede ser necesario añadir un aislamiento eléctrico de los componentes (aislantes, elementos plásticos o arandelas de poliamida).
- Es muy conveniente, buscar una buena ubicación de la unión en una zona no expuesta a la humedad.
- Puede ser necesario recubrir el metal que actúe como cátodo, o de ambos (ánodo y cátodo), tanto en superficies grandes, como localmente, cerca de las uniones.
- Sólo recubrir el ánodo no es una buena manera de evitar la corrosión galvánica.
- La imperfección del recubrimiento o los daños causados durante la instalación son difíciles de evitar in situ, y crean un elemento de corrosión crítico. Cualquier daño en el recubrimiento pone al descubierto un pequeño ánodo, que podría, por tanto corroerse rápidamente.
- Para reducir el efecto catódico del metal, por lo general es suficiente con recubrirlo alrededor de la unión. La magnitud de la zona a proteger depende de la conductividad del entorno corrosivo. En elementos expuestos a un ambiente poco agresivo y películas de electrolito bastante finas y débilmente conductoras, por lo general es suficiente con recubrir únicamente un área de unos cuantos centímetros a lo largo de la zona de contacto del metal. En ambientes salinos, el área de protección del cátodo efectivo habría de superar los 10 cm.

